양치질을 열심히 잘 하는 것이 암 예방에 필수적이라면 놀라시는 분들도 있을 것입니다.
옛말에 치아가 튼튼한 것이 오복중 하나라고 할 만큼 치아의 건강을 중요시 여겼는데요,
입속 건강이 결국 온 몸의 건강에 영향을 미친다는 사실이 푸소박테리아를 통해 어느정도 사실임을 확인할 수 있습니다.
췌장암을 일으키는 박테리아가 입속에 서식하는 박테리아라는 이야기를 들어본 사람이 있을 것입니다.
일전에 헬리코박터 파일로리 균이 위암의 중요한 원인 중 하나로 꼽힌다는 논문을 올렸는데요,
경구에 서식하는 푸소 박테리아가 결국 대장암, 결직장암, 췌장암, 유방암에서 또한 발견이 되고, 암의 전이와 증식에 관여한다고 하고 있습니다.
헬리코박터 파일로리 균이 암세포를 이끄는 박테리아라고 한다면, 푸소박테리아는 승객 정도로, 살짝 수동적으로 관여하고 있지만, 암의 증식에 분명 영향을 준다고 볼 수 있습니다.
또한 암 발병의 지표로서도 사용될 수 있어 암진단법에 획기적인 변화가 있을 수 있다는 가능성을 제시하네요.
아래 논문 내용은 복잡해 보일 수 있지만, 암의 발병에 매우 흥미로운 사실들을 밝히고 있습니다.
살펴보시면서, 모두 입속 건강 잘 챙기시고, 양치질을 열심히 합시다 :)
Fusobacterium nucleatum and cancer - PMC (nih.gov)
Fusobacterium nucleatum and cancer
Accumulating evidence demonstrates that the oral pathobiont Fusobacterium nucleatum is involved in the progression of an increasing number of tumors types. Thus far, the mechanisms underlying tumor exacerbation by F. nucleatum include the enhancement ...
www.ncbi.nlm.nih.gov
논문초록
축적된 증거는 경구용 병리인 푸소박테리움 뉴클레아툼이 증가하는 종양 유형의 진행에 관여한다는 것을 보여줍니다. 지금까지 F. 뉴클레아툼에 의한 종양 악화의 기본 메커니즘에는 증식 향상, 종양 촉진 면역 환경 구축, 내화학성 유도 및 면역 체크포인트 활성화가 포함됩니다. 이 검토는 푸소 박테리아에 의한 종양 특이적 집락화를 매개하는 메커니즘에 초점을 맞춥니다. 푸소박테리아 종양 친화성 및 촉진을 매개하는 메커니즘을 설명하면 종양 검출 및 치료를 위한 새로운 접근 방식 개발에 대한 새로운 통찰력을 제공할 수 있습니다.
1. 감염원과 암
1911 년, 암에서 미생물의 인과 적 역할은 육종이 바이러스에 의해 닭에서 유발 될 수 있음을 입증 한 Peyton Rous에 의해 처음 밝혀졌습니다. 바이러스와 인간 암 사이의 연관성은 전자 현미경으로 시각화 된 버킷 림프종 세포에서 엡스타인-바 바이러스의 존재에 의해 입증 된 바와 같이 53 년 후 Epstein, Achong 및 Barr에 의해 입증되었습니다. 그 뒤를 이어 B형 간염 및 C형 간염 바이러스와 간암, 유두종바이러스와 자궁경부암, 헤르페스 바이러스와 카포시 육종의 연관성이 나타났습니다.
암에서 중요한 역할을 하는 바이러스와 달리 박테리아는 처음에는 항암제로 간주되었습니다(참고 문헌 4 ). 1813 년 Vautier는 가스 괴저가 발생한 암 환자가 종양 퇴행을 보였다고보고했습니다. 독일 의사 Busch와 Fehleisen은 단독으로 고통받는 암 환자에서 종양의 퇴행을 독립적으로 관찰했습니다. 1868년 Busch (부쉬)는 암 환자에게 단독을 감염시키고 종양 수축을 관찰했습니다. 1882 년 Fehleisen은이 치료법을 반복하여 Streptococcus pyogenes를 단독의 원인균으로 확인했습니다. 또한 1890년대 초 미국에서는 윌리엄 콜리(William Coley)라는 외과의사가 항종양 면역을 불러일으키고 암 환자를 성공적으로 치료하기 위해 박테리아와 그 추출물(콜리 독소)의 사용을 개척했습니다. 그러나 새로 개발된 방사선 요법의 높은 수준의 성공으로 인해 Coley의 독소를 암 치료제로 적용하는 것이 감소했습니다(참고 문헌 7 ).
박테리아 기반 항암 치료는 1990년 FDA가 비침습성 방광암 치료를 위해 결핵에 사용되는 약독화 생균인 BCG(Bacillus Calmette-Guérin) 백신을 승인하면서 다시 등장했습니다. 현재 BCG는 일상적인 임상 용도로 승인된 유일한 항암 박테리아 제제입니다.
BCG 및 진균 유래 다당류β글루칸은 2차 감염성, 염증성 문제 및 종양에 대한 골수 및 자연 살해(NK) 세포의 지속적인 향상된 반응을 촉진할 수 있습니다. 선천성 면역 세포에 대한 이러한 비특이적 기억 과정은 미래의 도전에 대한 이러한 세포와 자손의 반응을 촉진하며 "훈련된 선천성 면역" 또는 "선천적 면역 기억"이라고 불립니다.훈련된 면역은 전사체, 후성유전학 및 대사 재프로그래밍을 통해 매개됩니다. NK 세포, 그리고 유도 훈련 된 면역, 비침습성 방광암에 대한 BCG 면역 요법에서 중요한 역할을 하는 것으로 가정됩니다.
1990년대에 헬리코박터 파일로리가 위암의 원인균이라는 사실을 알게 된 것은 박테리아가 종양 촉진에 관여한다는 것을 나타냅니다. 또한, 유전적으로 암에 걸리기 쉬운 쥐는 기존의 미생물군을 가진 쥐보다 무균 조건에서 훨씬 적은 수의 종양이 발생하여 박테리아의 종양 유발 역할을 뒷받침합니다.
고급 게놈 시퀀싱 및 마이크로바이옴 특성화 방법을 사용하는 연구는 박테리아 종과 특정 암의 연관성을 나타냅니다. 증식, 생존, 진행, 면역원성, 민감성 및 치료에 대한 내성을 포함한 종양의 여러 특징은 미생물 환경의 구성 요소와의 상호 작용에 의해 영향을 받습니다. 일부 박테리아 종은 암을 촉진할 수 있지만 암의 풍부도가 감소한 것으로 밝혀진 박테리아는 암 억제 작용 또는 종양 촉진 박테리아와 길항적 상호작용을 할 수 있습니다.
잠재적인 암 유발 요인으로 제안된 첫 번째 박테리아 중에는 단일 가닥 DNA 절단을 유도할 수 있는 콜리박틴(colibactin)이라는 돌연변이 유발 독소를 생성하는 대장균 균주와 유전독성이 있고 종양 억제 단백질 E-cadherin을 절단할 수 있는 프래길리신 발현 박테로이데스 프래질리스(Bacteroides fragilis)가 있습니다. Streptococcus gallolyticus (이전 Streptococcus bovis) 균혈증은 1951 년 이래로 대장 암의 지표입니다; 그러나 특정 박테리아-암 상호 작용은 이해되지 않습니다. 전반적으로 암 발병률의 약 16%에서 20%는 감염원과 관련될 수 있습니다. 최근 보고서는 7 개의 고형 종양의 미생물 군집을 포괄적으로 특성화했습니다.
암은 치주 병리의 영향을 받는 동반 질환 중 하나입니다. 검토의 초점인 Fusobacterium nucleatum은 주로 치주염의 발병과 관련된 구강 종양 종양입니다. 매우 풍부한 F. nucleatum은 결장직장암(CRC)을 포함한 다양한 유형의 암에서 검출되었으며,췌장,식도 그리고 유방암,CRC, 췌장암 및 식도암 환자의 생존 기간 단축과 관련이 있습니다. F. nucleatum이 종양 형성을 가속화한다는 증거 축적, 화학 요법에 대한 내성을 유도합니다. 다량의 F. 뉴클레아툼과 불량한 질병 결과의 연관성에 대한 합리적 근거를 제공할 수 있습니다.
F. 뉴클레아툼이 종양 진행 및 전이를 가속화하고 종양 내화학성을 유도하는 메커니즘은 이전에 철저히 검토되었습니다. 이 논문은 종양 특이적 집락화를 안내하고 항종양 면역으로부터 종양을 보호하는 푸소박테리아 메커니즘에 초점을 맞춥니다.
2. 구강 내 푸소박테리아 뉴클레아툼 FUSOBACTERIUM NUCLEATUM
푸소박테리움 뉴클레아툼(Fusobacterium nucleatum)은 그람 음성, 방추형, 비포자 형성, 구강 혐기성 미생물이며 인간 구강에 서식하는 가장 풍부한 그람 음성 종 중 하나입니다. 그것은 치주 질환에 선행하는 dysbiosis에서 자라는 병리학 중 하나입니다. Porphyromonas gingivalis와 같은 키스톤 종을 지원합니다. 숙주-미생물 항상성을 방해하고 치주염을 유발합니다. 혀의 등쪽 표면에서 찾을 수 있습니다. 그리고 치아의 치은 가장자리에 있는 다종 생물막에서 치은연하 치태의 발달에 중요한 역할을 하는 것으로 가정됩니다. 풍부한 접착 메커니즘으로 인해 F. nucleatum은 많은 구강 박테리아 종에 결합할 수 있습니다. 서로 다른 구강 식민지 개척자 사이의 부착을 공동 응집 또는 공동 부착이라고합니다. Streptococcus 종(RadD 부착을 통해)과 같은 구강 표면에 부착할 수 있는 초기 구강 집락 형성자와의 공동 응집으로, 및 Porphyromonas gingivalis(아래에서 논의될 Fap2를 통해), Treponema denticola 및 Aggregatibacter actinomycetemcomitans를 포함하여 치주 질환과 관련된 주로 혐기성 <>차 집락 형성자, 그리고 이들을 연결하는 F. nucleatum은 타액과 치은 열구균에 의한 세척에 저항할 수 있는 구강 생물막에서 난투와 같은 구조적으로 지지적인 역할을 합니다. 다종 브리징은 또한 의사 소통, 교차 수유 및 대사 상호 작용을 포함한 다종 공동체 존재를 촉진합니다(그림 1)
3. FUSOBACTERIUM NUCLEATUM은 대장암에 과잉 풍부합니다.
CRC는 미국에서 암 사망의 두 번째로 흔한 원인입니다. 전 세계적으로 암 관련 사망의 네 번째 주요 원인입니다. CRC의 부담은 개발 도상국이 서구 생활 방식을 채택함에 따라 급격히 증가하고 있습니다. 2012 년에 응용 전산 접근법을 사용하는 두 연구에서 인접한 정상 조직에 비해 대장 암 조직에서 fusobacteria (특히 F. nucleatum) DNA 또는 RNA 수준이 증가한 것으로 나타났습니다. 이 발견은 fusobacteria가 인간 구강 미생물 군집의 핵심 상주 구성원이며 장에서 드물게 발견되기 때문에 예상치 못한 것입니다. 생검 샘플에서 직접 분리된 Live F. nucleatum 및 생쥐의 환자 유래 이종 이식 이러한 메타게놈 결과를 확인했습니다. 흥미롭게도 F. nucleatum-high 대장암의 비율은 직장암에서 맹장암으로 점차 증가했습니다. 놀랍게도, F. 뉴클레아툼과 CRC 환자 사이의 더 강한 연관성은 유럽과 미국 인구보다 아시아 인구에서 발견되었습니다. 또한, CRC 환자에서 F. 뉴클레아툼은 Peptostreptococcus spp.를 포함한 다른 경구 혐기성 종에서 자주 검출되었습니다. 렙토 트리 키아 (Leptotrichia)와 캄 필로 박터 (Campylobacter). 증가하는 증거는 결장암에서 F. 뉴클레아툼의 존재가 화학 요법에 대한 내성, 질병 재발 및 불량한 예후와 관련이 있음을 나타내며, 이는 아래 섹션 9에서 자세히 논의될 것입니다.
4. CRC 관련 F. 뉴클레아툼은 구강 미생물군에서 유래합니다.
F. nucleatum은 일반적인 구강 분리주이지만 장내 미생물총에서 풍부하게 발견되지 않습니다. 따라서 결장암 샘플에서 검출된 푸소박테리아는 경구 기원으로 추측됩니다. 이 가설을 확인하기 위해 14명의 CRC 환자로부터 결장암 검체와 일치하는 타액 샘플을 수집하고 361명의 종양(57.1%)과 14명의 환자 모두의 타액에서 F. 뉴클레아툼 균주(n = 75)를 분리했습니다. 종양 및 구강 분리주의 임의로 프라이밍된 PCR 산물의 일치하는 패턴은 <>명의 환자 중 <>명(<>%)에서 발견되었으며, 이는 결장암 종양에서 발견되는 푸소박테리아가 구강에서 유래했음을 시사합니다. 이러한 결과를 추가로 검증하기 위해 3명의 환자로부터 쌍을 이루는 구강 및 선암 샘플에서 얻은 F. nucleatum의 게놈 DNA를 분리했습니다. 게놈 DNA를 시퀀싱하고 SRA(Sequence Read Archive) 데이터베이스에 기탁된 사용 가능한 푸소박테리아 게놈과 비교했습니다. 그 결과 각 구강과 일치하는 종양 분리주 사이의 매우 밀접한 진화적 관계가 밝혀졌으며, 이에 따라 구강의 푸소박테리아가 대장암에 씨를 뿌리고 농축될 수 있습니다. Peptostreptococcus spp.를 포함한 잠재적인 경구 공동 응집 파트너가 있는 종양에서 F. nucleatum의 빈번한 동시 발생. 렙토 트리 키아 (Leptotrichia)와 캄 필로 박터 (Campylobacter spp.), 또한 결장직장암에 서식하는 푸소박테리아의 경구 기원을 입증합니다.
5. 경구 F. NUCLEATUM은 혈행 경로를 통해 결장직장 종양으로 전위될 수 있습니다.
결장암 관련 푸소박테리아의 구강 기원을 고려할 때 경구에서 종양으로의 전파 경로는 아직 해결되지 않았습니다. Kostic 외 구강 fusobacteria가 소화관을 통해 하강하여 결장 종양에 도달할 수 있음을 입증했습니다.그러나 빈번한 치은 출혈 중에 발생할 수 있는 혈행 전좌 도 가능합니다. 태반으로의 구강 fusobacteria의 이러한 혈행 전이는 이전에 관찰되어 조산에서 높은 발생을 설명합니다. (이 책에서 Y. W. Han이 검토함).
아베드 연구진은 두 개의 직교 이방성 마우스 결장암 모델, 즉 C38BL/57 마우스의 MC6 및 BALB/C 마우스의 CT26을 사용하여 선호하는 구강 종양 경로를 연구했습니다. 그들은 꼬리 정맥을 통해 혈관 내 주사되거나 경구 위관영양을 통해 투여된 F. nucleatum에 의한 결장 종양 집락화를 비교했습니다. 테스트된 조건에서 혈관 내 주입된 푸소박테리아에 의한 종양 집락화는 두 마우스 모델에서 위관영양법 접종된 푸소박테리아보다 더 효율적입니다. 정맥 주사된 푸소박테리아는 분만 후 26시간에 마우스 CT2 결장 종양에서 검출되었으며 그 수준은 감염 후 6시간 동안 안정적으로 유지되었습니다. 종양에서 푸소박테리아 증식은 감염 후 24시간 및 72시간에 관찰되었습니다.
치과 시술과 일상적인 일상 활동 후에 발생하는 균혈증의 크기는 현저히 낮습니다(<104 CFU/ml) 상술한 실험에서 시험된 것보다 (1 × 107–1 × 108 F. 마우스당 뉴클레아툼). 그러나 직교이방성 MC38 CRC 모델에서 생리학적 용량으로 푸소박테리아를 접종했을 때 더 많은 생리학적 용량 범위로 접종한 마우스에서도 종양 관련 푸소박테리아가 검출되었습니다(1 × 104 F. 뉴클레아툼). 증가된 용량은 종양 간 푸소박테리아가 있는 생쥐 보유 종양의 비율을 증가시키는 결과를 가져왔습니다. 구체적으로, 45 × 5을 접종 한 생쥐 보유 종양의 10 %의 종양에서 fusobacteria가 검출되었다. 따라서 푸소박테리아 접종 용량을 낮추는 것은 결장 종양 집락화를 억제하는 것이 아니라 오히려 효율성을 감소시켰습니다. 이러한 결과는 인간 결장직장암의 3% 내지 56%에서 푸소박테리아 발생에서 관찰되는 이질성을 설명할 수 있습니다.
위의 결과는 지속적으로 삼키는 구강 fusobacteria가 소화관을 통해 결장 종양을 식민지화 할 수 있다는 것을 배제하지 않습니다. 그러나 CRC에 대한 경구 푸소박테리아의 혈행 전파는 혈류 이동이 위장관으로 하강할 때 발생하는 낮은 위 pH 및 담즙산의 독성을 우회하기 때문에 생물학적으로 생각할 수 있습니다. 또한, 혈류 이동은 fusobacteria가 내인성 결장 미생물군과의 경쟁에서 벗어날 수 있도록 합니다.
6. FAP2-글리칸 상호작용은 대장암에서 F. 뉴클레아툼 집락화를 안내합니다.
구강 푸소박테리아가 혈액 순환을 통해 결장 종양으로 전위되든 소화관을 통해 하강하든, 푸소박테리아를 결장직장 종양으로 가정하고 국한시키는 메커니즘이 존재해야 합니다. 혈액 공급 증가, 혈관 누출, 저산소증 및 면역억제 미세 환경을 포함한 종양 유발 상태는 푸소박테리아 생존을 촉진하는 틈새 시장에 기여할 수 있는 비특이적 요인입니다. 그러나 이러한 국소 환경 조건은 포르피로모나스 진지발리스(Porphyromonas gingivalis)와 같은 다른 풍부한 구강 혐기성 박테리아를 결장암에 국한시키기에 충분하지 않은 것 같습니다. 따라서 fusobacteria에 의한 CRC 집락화에 특정 요인과 메커니즘이 필요할 수 있습니다. 현재의 증거는 F. nucleatum에 의한 종양 국소화가 글리칸-렉틴 상호작용에 의해 결정된다는 것을 시사합니다.
D-갈락토오스β(1-3)-N-아세틸-D-갈락토사민(Gal-GalNAc) 또는 알려지지 않은 구조적 관련 당 부분이 푸소박테리아 부착을 위한 종양 리간드로 가정됩니다. Gal-GalNAc는 결장직장 선암의 절편에서 과다 표시되는 것으로 밝혀졌으며 결장암의 바이오마커로 제안되었습니다. GalNAc 및 GalNAc는 O-GalNAc 글리칸 및 단백질 번역 후 변형입니다. O-GalNAc 글리 칸의 생합성에서 첫 번째 단계는 N-아세틸 갈락토사민 (GalNAc)과 수용체 단백질의 선택된 Ser / Thr 잔기의 공유 결합을 포함하여 GalNAcα1-O-Ser / Thr (Tn-항원이라고도 함)을 생성합니다. 갈락토오스(Gal) 단당류는 GalNAcα1-O-Ser/Thr에 연결되어 결과적으로 Galβ3GalNAcα1-O-Ser/Thr(Gal-GalNAc-O-Ser/Thr)을 생성할 수 있으며, 이는 코어 1 글리칸, T-항원 또는 Thomsen-Friedenreich 항원이라고도 합니다. 정상 세포에서 인간 및 많은 포유류 세포에서 우세한 시알산인 N-아세틸뉴라민산은 GalNAc 및 Gal-GalNAc 잔기를 캡핑하고 마스킹하기 위해 자주 첨가됩니다. 그러나 많은 암종 (예 : CRC)에서 절단 된 O-GalNAc 글리 칸이 형성되고 노출 된 GalNAc 및 Gal-GalNAc에 시알 산이 첨가되지 않습니다. 그 결과, 결장암과 폐암, 유방암 및 간암을 포함한 추가 인간 종양에서 높은 수준의 GalNAc(Tn 항원) 및 Gal-GalNAc(T 항원)가 검출되었습니다. 이러한 높은 수준의 마스킹되지 않은 Tn- 및 T- 항원은 종양 침윤 및 전이와 관련이 있습니다.
치태에서 많은 그람 음성 종과 F. 뉴클레아툼의 공동 응집은 갈락토오스 및 GalNAc에 의해 억제될 수 있으며, 이는 F. 뉴클레아툼이 이러한 공동 응집 파트너 박테리아의 수용체에 존재하는 이러한 당 분자에 결합하는 렉틴(이전에는 부착이라고 함)을 발현함을 나타냅니다. 트랜스포존 돌연변이 유발 및 돌연변이 스크리닝 결과는 외막 Fap2 단백질을 GalNAc 억제 공동 응집을 매개하는 푸소박테리아 렉틴으로 확인했습니다. 흥미롭게도, 이전 연구에서, Fap2는 림프구에서 세포자멸사를 유도하는 F. 뉴클레아툼의 능력을 가능하게 하는 것으로 밝혀졌다. 따라서 Fap2가 림프구에 대한 F. 뉴클레아툼의 결합을 매개하고 추가적인 푸소박테리아 인자가 이러한 세포자멸사 매개 면역 회피 메커니즘을 유도할 수 있도록 하는 것이 타당합니다.
Gal-GalNAc는 결장 종양에 의해 과다 표시되기 때문에 푸소박테리아 Fap2의 종양 표적이 될 가능성이 있습니다. 이와 일치하여, 결장암 세포주 및 결장암 절편에 대한 F. 뉴클레아툼의 부착은 표적 세포에서 검출된 Gal-GalNAc의 양과 상관관계가 있었습니다. 또한, O-글리카나제 처리시 부착이 감소되고 용량 의존적 방식으로 가용성 GalNAc에 의해 억제되었습니다. Fap2-불활성화된 F. 뉴클레아툼 돌연변이체 및 Fap2 혈구응집 활성이 결핍된 임상 F. 뉴클레아툼 분리주는 결장 종양 세포주 및 임상 표본에 대한 부착 장애를 나타냈다. 더 중요한 것은 IV 접종된 Fap2 결핍 F. 뉴클레아툼 돌연변이체가 결장암 마우스 모델을 집락화하는 데 장애가 있었다는 것입니다.
7. GAL-GALNAC은 많은 선암종에서 과도하게 표시됩니다.
증거는 경구 F. 뉴클레아툼이 결장암 종양으로 혈행성으로 전위되고 특이적으로 식민지화될 수 있음을 시사합니다. 결장암에서 많이 나타나는 Gal-GalNAc (또는 관련 당)에 대한 인식 및 부착을 통해. 이것은 F. nucleatum이 동일한 메커니즘을 통해 다른 Gal-GalNAc 표시 종양에 도달할 수 있음을 나타냅니다.
높은 Gal-GalNAc 수치를 나타내고 푸소박테리아의 표적이 될 수 있는 종양에 대한 스크리닝을 수행했으며, Gal-GalNAc 특이적 렉틴인 형광 표지 땅콩 응집소(PNA)를 기반으로 20가지 다른 유형의 종양에 대한 Gal-GalNAc 수치를 측정했습니다. 이전 보고서와 일치하여, 높은 Gal-GalNAc 수치는 선 기원 및/및 특성을 가진 10가지 종양 유형의 상피 조직에서 검출되었습니다(그림 2ᅡ). 그 중 9개는 선암, 즉 위, 전립선, 난소, 결장, 자궁, 췌장, 유방, 폐, 식도였습니다. 나머지 하나는 자궁 경부의 편평 세포 암종이었습니다. 또한, Gal-GalNAc 수치는 일치하는 정상 대조군 조직보다 이들 선암 중 7개에서 유의하게 더 높았다(그림 2ᄂ), 정상 대조군 샘플의 위, 폐 및 자궁경부에 있는 샘플은 높았고 각각의 선암종과 유사했습니다.

Gal-GalNAc 수치는 인간 선암에서 증가합니다. (A) 종양은 증가하는 Gal-GalNAc 수준에 따라 배열됩니다. 높은 수준의 Gal-GalNAc를 나타내는 검사된 선암종은 짙은 회색으로 표시됩니다(오른쪽). (B) (A)에 기술된 종양(음영 점)의 Gal-GalNAc 수준을 일치하는 정상 조직 대조군(중공 점)의 수준과 비교했습니다. 조사된 05개의 선암 중 01개는 일치하는 대조군 조직보다 유의하게 더 높은 Gal-GalNAc 수준을 보였습니다. 식도, 폐 및 피부에 대한 정상 조직 대조군은 각각 식도 선암 및 식도 편평 세포 암종(Esophagus SCC), 폐 선암 및 폐 SCC, 흑색종 및 SCC에 대해 각각 0001회 사용하였다. 각 기호는 다른 환자의 샘플의 형광 강도를 나타냅니다. 데이터는 평균 ± SEM으로 표시됩니다(*P < .0001, **P < .<>, ***P = .<> 양측 Mann-Whitney 검정으로 분석; ****P < .<> 양측 t-검정으로 분석). 이 그림은 참고입니다.
fusobacteria가 높은 Gal-GalNAc 수치를 나타내는 암에 서식하고 축적 될 수 있다는 추측에 동의하여, fusobacterial DNA 수치는 췌장에 과잉 풍부하다고보고되었습니다. 식도 위의 자궁 경부 그리고 유방 선암. 중요한 것은 대장암의 유병률과 유사하게, 췌장 종양에서 푸소박테리아 발생은 더 짧은 생존과 관련이 있었습니다. 식도암에서 높은 수준의 F. 뉴클레아툼 핵산은 또한 더 짧은 생존과 관련이 있었습니다. 및 신보강 화학요법에 대한 반응이 좋지 않습니다.
흥미롭게도 높은 수준의 Gal-GalNAc가 태반에서도 발견됩니다. F. nucleatum이 병리학과 관련이있는 또 다른 구강 외 틈새 (Y. W. Han이이 책에서 검토). Fap2-비활성화 돌연변이는 태반 집락화가 결핍되었고, Fap2-Gal-GalNAc 상호 작용은 종양 집락화와 유사하게 F. nucleatum에 의한 태반 집락화에 관여할 수 있음을 시사합니다.
8. F. NUCLEATUM에 의한 유방암 집락화
Fusobacterium nucleatum은 유방암 미생물 군집이 풍부하며, 이는 fusobacteria가 순환계를 통해 종양에 도달 할 수 있다는 가설을 뒷받침합니다. 유방암에 초점을 맞춘 연구 Gal-GalNAc 수치는 결장암, 즉 선종에서 선암으로의 전이와 유사하게 인간 유방암의 진행과 함께 증가한다는 것을 밝혀냈습니다. Gal-GalNAc 수치의 가장 극적인 상승은 증식에서 비정형 증식으로의 전환에서 발생합니다. 일련의 사건으로 발생하는 유방암은 비종양성 상피 세포가 증식, 비정형 증식, 상피내암종, 그리고 결국 침윤성 선암종을 겪는 것으로 시작됩니다. 양성 증식에서 상피내암종으로의 전환(침윤성 암종 이전 단계)은 증식에서 비정형 관 증식으로의 전환에서 발생하는 것으로 추측됩니다. 중요하게도, 유방암 샘플에서 F. nucleatum gDNA의 존재는 높은 Gal-GalNAc 수준과 상관관계가 있었습니다. 유방암의 마우스 모델에서 fap2-발현 F. nucleatum ATCC 23726을 혈관내 접종했을 때 유방 종양의 특이적 집락화가 관찰되었습니다(그림 3). 대조적으로, fap2-불활성화된 F. 뉴클레아툼 돌연변이체는 손상된 종양 집락화를 나타냈다. AT57 유방암 세포가 정소적으로 이식된 C6BL/3 마우스에 F. 뉴클레아툼을 접종한 결과 종양 침윤 CD4+ 및 CD8+ T 세포의 축적이 손상되었습니다. F. nucleatum-접종된 마우스에서 얻은 종양은 접종되지 않은 마우스의 종양보다 부피가 훨씬 더 컸습니다. 폐 전이의 진행은 또한 F. nucleatum 감염 그룹에서 유의하게 향상되었다. 마우스에서 푸소박테리아 유발 유방 종양 성장 및 전이성 진행은 Fap2 의존성인 것으로 밝혀졌으며 항생제 치료로 예방할 수 있었습니다. F. nucleatum 또는 Fap2를 표적으로 하는 것이 유방암 치료에 도움이 될 수 있음을 시사합니다. 이러한 결과는 인간 유방암에서 F. 뉴클레아툼의 존재를 나타내지만, 인간 유방암 발병 및 치료 결과에서 푸소박테리아의 가능한 역할은 아직 임상 환경에서 조사되지 않았습니다.
9. F. NUCLEATUM에 의한 종양 악화
현재까지 F. nucleatum은 결장 선암에서 과잉 증식으로 보고되었으며, 식도암, 췌장암 그리고 유방암. Fusobacteria의 존재는 결장암, 직장암, 췌장암 및 식도암의 예후가 좋지 않은 것과 관련이 있습니다. 결장직장암 및 식도암의 치료 실패. 결장암 및 유방암의 동물 모델에서 F. 뉴클레아툼은 종양 성장 및 전이성 진행을 가속화했습니다. F. nucleatum에 의한 종양 가속은 증식의 촉진을 수반하며, pro-tumorigenic 면역 미세 환경의 생성, 종양 침윤 림프구(TIL) 수의 감소. F. 뉴클레아툼은 푸소박테리아 Fap2의 비-렉틴 도메인을 이용함으로써 인간 TIGIT 체크포인트를 활성화시킴으로써 종양 부위에 도달하는 일부 TIL들 및 NK 세포의 항-종양 활성을 추가로 억제한다. 그리고 fusobacterial CbpF를 통한 인간 CEACAM1 체크포인트. 이 섹션에서는 F. nucleatum에 의해 유도된 종양 악화의 다양한 메커니즘에 대해 논의합니다.
9.1. 푸소박테리움 뉴클레아툼은 종양 세포의 증식을 촉진합니다.
F. nucleatum 12230의 FadA 부착물은 시간 의존적 방식으로 인간 결장암 세포주 HCT116, DLD1, SW480 및 HT29의 증식을 자극하는 것으로 나타났습니다. E-cadherin과의 FadA 상호 작용은 clathrin-mediated endocytosis를 통해 E-cadherin-발현 세포의 박테리아 부착 및 침입을 촉진했습니다. HCT116 세포와 FadAc(FadA 활성 복합체)의 짧은 배양 기간은 E-카데린의 종양 억제 활성을 손상시켜 β-카테닌의 인산화를 감소시키고 결과적으로 안정성과 핵으로의 전좌를 증가시켰습니다. β-카테닌의 핵 전좌는 Wnt 경로를 활성화하고 NF-κB와 종양유전자 Myc 및 Cyclin D1의 발현을 향상시킵니다. 이러한 시험관내 결과와 일치하여, 정상 조직과 비교하여 인간 암성 결장 조직에서 FadA, Wnt 7b(대표적인 Wnt유전자) 및 NFkB2발현의 현저한 증가가 검출되었습니다. Annexin A1은 나중에 F. nucleatum이 세포 증식에 자극 효과를 발휘하는 핵심 성분으로 밝혀졌습니다. siRNA에 의한 ANXA1(Annexin A1 유전자)의 하향조절은 E-cadherin을 암호화하는 CDH1의 억제와 유사한 방식으로 F. 뉴클레아툼 결합 및 침윤을 효과적으로 감소시켰습니다. 이러한 결과는 재조합 FadA가 용량 및 시간 의존적 방식으로 SW480 결장암 세포의 증식을 촉진한다는 것을 입증하는 독립적인 연구에 의해 뒷받침됩니다.
Fusobacterium nucleatum은 또한 microRNA 21(miR21)을 상향 조절하여 결장암 세포의 증식 및 침윤을 향상시킬 수 있습니다. 47 HCT116, HT29, LoVo 및 SW480을 포함한 21개의 인간 결장직장암 세포주에 대한 microRNA 스크리닝은 miR21이 F. nucleatum과 함께 배양할 때 가장 상향조절된 miRNA임을 밝혀냈습니다. F. 뉴클레아툼은 MYD88 의존성 Toll-like 수용체 4 신호 전달 경로를 활성화하여 miR21의 발현을 증가시켜 핵 인자-κB(NF-κB) 신호 전달 경로를 상향 조절합니다. MiR1은 RASA<>에 의해 암호화된 RAS GTPase의 수준을 감소시켜 RAS-미토겐-활성화 단백질 키나아제(MAPK) 캐스케이드를 활성화합니다. 일관되게, miR21의 억제는 세포 증식 및 침윤을 억제하였다. 90개의 인간 일치 CRC 및 정상 조직을 분석한 결과, F. 뉴클레아툼 DNA 및 miR21 전사체가 대조군보다 암 조직에서 더 풍부했으며 그 수준이 더 진행된 종양에서 유의하게 더 높은 것으로 나타났습니다. 중요한 것은 종양에서 F. nucleatum DNA와 miR21의 높은 수치가 더 짧은 생존과 상관관계가 있다는 것입니다.
9.2. 푸소박테리움 뉴클레아툼은 CRC에서 내화학성을 촉진합니다.
화학 요법에 대한 내성은 CRC 환자에서 종양 재발 및 불량한 예후의 주요 원인입니다. F. nucleatum의 풍부함이 비재발 환자에 비해 화학요법 후 재발 환자의 CRC 조직에서 보고됨에 따라 연구에서는 푸소박테리아가 내화학성에 관여하는지 여부를 조사했습니다.
옥살리플라틴과 5-플루오로우라실(5-FU)은 CRC 치료에 널리 사용됩니다. 5‐FU는 DNA 복제 동안 티미딜레이트 합성효소의 활성을 억제하고, 옥살리플라틴은 DNA에 공유 결합하고 백금 DNA 부가물을 형성하여 G2 단계에서 세포주기 정지를 초래합니다. HCT116 및 HT29 인간 결장암 세포주를 F. nucleatum으로 감염시켜 자가포식소체의 LC3-II 마커의 발현을 유도하고, fusobacteria가 대장암 화학요법 반응을 유도할 수 있음을 시사합니다. 또한, F. nucleatum에 감염된 결장암 세포에 대한 옥살리플라틴 또는 5-FU 치료의 세포 독성이 현저히 감소되었습니다. 한편, 자가포식 리소좀 억제제인 클로로퀸(CQ)을 첨가하면 약물 세포독성이 회복되었습니다. F. 뉴클레아툼 노출 후, miR-18a 및 miR-4802의 발현은 종양 세포의 miRNA 중에서 가장 현저하게 하향 조절되었으며, 이들의 수준은 자가포식 요소 ULK1 및 ATG7의 수준과 반비례 상관관계가 있었습니다. miR-18a 및 miR-4802 수준의 F. 뉴클레아툼 유도 감소는 TLR4/MYD88 신호 전달 경로에 의존적이었습니다. 제안된 메커니즘은 암세포가 F. 뉴클레아툼에 노출되면 TLR4 및 MYD88 신호 전달 경로를 활성화하여 miR-18a 및 miR-4802의 발현을 하향 조절하여 세포자멸사에서 자가포식 및 약물 내성으로의 전환을 유도한다고 추측합니다.
F. 뉴클레아툼이 5-FU에 대한 화학감수성의 변화를 유도하기 위해 세포자멸사를 조절하는 추가 메커니즘도 설명되었습니다. 예를 들어, F. 뉴클레아툼 감염은 HCT3 및 HT4 세포에서 TLR116/NF-kB 신호전달을 통해 BIRC29를 상향조절하는 것으로 보고되었다. 아폽토시스 단백질 억제제(IAP) 패밀리의 구성원인 BIRC3는 카스파제 캐스케이드를 직접 억제하여 아폽토시스를 억제할 수 있습니다. BIRC3의 소분자 길항제인 SMAC 모방체는 F. 뉴클레아툼에 의해 유도된 화학내성을 점진적으로 감소시켰다. 인간 CRC 조직에서 높은 수준의 F. 뉴클레아툼은 높은 수준의 BIRC3와 상관관계가 있었습니다. 또한, 높은 수준의 F. nucleatum, TLR4 및 BIRC3는 재발이 없는 환자보다 재발이 있는 CRC 환자에서 검출될 가능성이 더 높았습니다. 또 다른 연구에서, HCT116 및 HT29 세포를 F. 뉴클레아툼과 함께 배양하면 인간 염화물 채널 단백질을 암호화하는 anoctamin-1 (ANO1)의 발현이 유의하게 상향 조절됩니다. ANO1은 염색체 11q13에 위치하며, 이는 두경부 편평 세포 암종, 방광암 및 유방암을 포함한 다양한 유형의 인간 암종에서 자주 증폭됩니다.
F. 옥살리플라틴 또는 5-FU로 처리된 뉴클레아툼 감염 세포는 현저히 낮은 수준의 세포자멸사를 보였다. 침묵 ANO1은 F. 뉴클레아툼의 보호 효과를 차단하고 세포자멸사를 증가시킨 반면, 과발현은 F. 뉴클레아툼 유도 내화학성을 더욱 증가시켰습니다. 51
푸소박테리움 뉴클레아툼 유도 자가포식 매개 화학내성은 식도 편평 세포 암종(ESCC)에서도 설명되었습니다. F. 뉴클레아툼 수치가 높은 ESCC 환자는 F. 뉴클레아툼 수치가 낮은 환자보다 화학요법 치료에 대해 더 높은 내성을 나타냈다. 자가포식 마커인 LC3는 대조군에 비해 F. 뉴클레아툼 처리된 ESCC 세포에서 주로 검출되었습니다. 또한, TE8 및 TE10 인간 ESCC 세포에서 자가포식 유도에 필수적인 인자인 ATG7의 발현은 F. nucleatum으로 배양한 후 유의하게 증가하였다. ESCC의 핵심 화학요법제인 도세탁셀, 시스플라틴(CDDP) 또는 5-FU로 치료할 때, F. 핵세포에 감염된 TE8 및 TE10 세포는 감염되지 않은 대조군 세포보다 유의하게 높은 성장률을 보였다. 감염된 세포에 CQ 첨가는 세포 성장을 감소시켰다. 이러한 시험관 내 결과와 일치하게, F. nucleatum과 자가포식 마커 ATG7 및 LC3의 수준 사이에 양의 상관관계가 인간 ESCC 조직에서 관찰되었습니다.
9.3. Fusobacterium nucleatum은 종양 허용 면역 미세 환경을 구축합니다.
면역 세포와 그 이펙터는 종양 제어 및 진행에 중요한 역할을 합니다. 종양 면역 미세 환경을 조작하는 F. nucleatum의 능력은 C57BL/6에서 처음 입증되었습니다 증권 시세 표시기최소/+ 장 종양 형성의 마우스 모델. 선종성 용종증 대장균(Apc)은 종양 억제 유전자이며 C57BL/6 Apc 최소/+ 생쥐는 자발적으로 장암을 앓습니다. F. nucleatum을 반복적으로 경구 접종했지만 Streptococcus sanguinis(대조군)는 접종하지 않았으며, 이 마우스에서 종양 다중도가 증가했습니다. fusobacteria에 의한 종양 촉진은 종양 진행을 촉진할 수 있는 종양 침윤성 골수 세포의 선택적 모집을 포함합니다. 이것은 푸소박테리아에 감염된 마우스에서 CD4+ T 세포를 억제하는 침윤성 골수 유래 세포의 수가 증가했기 때문에 결론지었습니다.
또한, 종양 진행 및 혈관신생을 촉진하고 항종양 면역을 손상시키는 종양 관련 호중구(TAN)와 T 세포 활성을 억제하는 종양 관련 대식세포(TAM, TAM 및 M2 유사 TAM 모두)의 확장은 대조군에 비해 F. 뉴클레아툼 감염 마우스 보유 종양에서 증가했다. 전사체 염기서열 분석 데이터를 분석한 결과, Apc의 종양이 최소/+ F. nucleatum에 노출된 마우스는 인간 푸소박테리아 양성 결장직장암과 공유되는 전염증성 발현 시그니처를 나타냈다. 높은 푸소박테리아 RNA 수준을 가진 인간 결장 종양의 전사체 분석은 푸소박테리움 유도 유전자, PTGS2(COX-2), IL1β, IL6, IL8 및 TNF(TNF-α)를 밝혀냈으며, 이는 결장직장 발암과 관련된 NF-κB 유발 전염증 반응을 나타냅니다.
9.4. 푸소박테리아 Fusobacterium nucleatum은 항암 종양 침윤 T 세포의 모집을 억제합니다.
축적된 증거에 따르면 종양 집락화된 F. 뉴클레아툼도 TIL의 모집을 방해할 수 있습니다. 결장직장암 조직에서 F. 뉴클레아툼의 풍부함은 T 세포 밀도와 반비례 상관관계가 있었습니다. 신보강 후 국소 치료된 진행성 직장암에서 푸소박테리아 지속성은 CD8 T 세포의 부족과 관련이 있었습니다.
유방암의 AT3 직교 이방성 마우스 모델에서 F. nucleatum은 TIL의 모집을 억제하여 암 진행을 가속화했습니다. AT57 세포를 이식하고 F. 뉴클레아툼을 IV-접종한 C6BL/3 마우스는 감염되지 않은 마우스보다 훨씬 더 큰 종양과 더 많은 폐 전이를 보였다. 메트로니다졸 치료는 박테리아의 종양 유발 효과를 감소시켰습니다. 박테리아 유도 종양 확대는 F. nucleatum에 감염된 마우스의 종양에서 검출된 CD4+ 및 CD8+ T 세포의 수가 더 적다는 것으로 입증되는 바와 같이 종양 부위로의 T 세포 모집 억제에 기인합니다. 유사하게, 푸소박테리아는 AT3 세포가 T, B 및 NK 세포가 결핍된 SCID 베이지색 마우스에 이식되었을 때 종양 확대를 유도하지 않았다. 따라서, 이러한 발견은 면역적격 C57BL/6 마우스에서 AT3 유방 종양의 성장이 NK, B 또는 T 세포에 의해 제한된다는 것을 나타낸다. 그러나, F. nucleatum의 존재 하에서, T 세포 수준은 감소되었고, 그 결과 종양 성장이 증가하였다. 면역 세포 수의 감소는 세포 사멸을 수반 할 수 있습니다. 아폽토시스는 Fap2를 통해 림프구에서 F. 뉴클레아툼에 의해 유도되었습니다. 중요하게도, F. 뉴클레아툼의 면역조절 전종양형성 효과는 종양에서 NK 및 일부 T 세포의 활성이 Fap2 및 TIGIT 사이의 억제 상호작용에 의해 추가로 약화될 수 있기 때문에 인간에서 더 중요할 것으로 예상된다. CbpF와 CEACAM 사이 체크포인트(아래 설명 참조).
9.5. Fusobacterium nucleatum은 면역 체크 포인트를 활성화합니다.
인간 대장암에서 F. nucleatum의 존재, 그리고 유방암의 마우스 모델에서 종양 부위의 TIL 수 감소와 관련이 있으며, 종양에 대한 NK 세포의 모집에 대한 푸소박테리아의 영향은 아직 보고되지 않았습니다. 놀랍게도, 다양한 종양 세포주에 대한 NK 세포의 종양 사멸 효과는 다양한 F. 뉴클레아툼 균주의 존재에 의해 억제되었습니다. 자가면역 반응과 정상 세포의 사멸을 방지하기 위해, 면역 세포의 활성은 억제 수용체의 큰 레퍼토리에 의해 부정적으로 조절될 수 있으며, 그 중 하나는 NK 세포를 포함한 많은 면역 세포에 의해 발현되는 억제 수용체인 TIGIT를 포함한다. 종양 부착 F. 뉴클레아툼은 푸소박테리아 Fap2 단백질과 인간 TIGIT 억제 수용체 사이의 상호작용을 통해 면역 세포 활성을 억제하였다. 보다 최근에, 추가적인 면역세포 억제 수용체 CEAMAM1의 활성화를 통한 F. nucleatum에 의한 면역세포 항종양 활성의 억제가 보고되었다. 따라서 푸소박테리아는 푸소박테리아 집락화된 종양 미세환경에 침투하는 면역 세포의 수를 줄이는 것 외에도 면역세포 항종양 활성을 억제하기 위해 체크포인트를 활성화하여 종양을 더욱 보호할 수 있습니다.
9.6. 푸소박테리움 뉴클레아툼은 암의 전이를 촉진합니다.
Fusobacterium nucleatum은 간 및 림프절로의 CRC 전이에서 검출되었습니다. 대장암의 간 전이 수 증가와 관련이 있습니다. 유방암의 마우스 모델에서 F. nucleatum은 폐 전이를 촉진했습니다. F. nucleatum의 존재는 또한 생쥐에서 CRC 환자 유래 이종이식의 성공적인 확립을 촉진하는 것으로 나타났습니다. F. 뉴클레아툼이 전이를 촉진하는 제안된 메커니즘은 종양 세포 이동 및 침윤을 자극하는 전염증성 사이토카인의 유도를 포함한다. F. 뉴클레아툼에 감염된 CRC 세포는 사이토카인 IL-8 및 CXCL1을 분비하며, 이는 감염된 세포와 감염되지 않은 세포의 침습적 운동성을 촉진합니다. F. nucleatum과 함께 배양할 때, 인간 및 마우스 유방암 세포는 또한 매트릭스 메탈로프로테이나제 9(MMP-9)의 과발현 및 분비 증가를 유도했습니다. MMP 패밀리의 프로테아제는 매트릭스 리모델링을 수반하는 많은 생물학적 공정에서 중요한 역할을 합니다. 특히, MMP-9 활성은 침윤, 혈관신생 및 전이를 포함하는 암 병리와 관련이 있다. 따라서 C3BL/57 마우스의 AT6 유방암 모델에서 F. 뉴클레아툼 작용의 추정되는 주요 메커니즘인 면역 조절 외에도 MMP의 유도는 F. 뉴클레아툼이 유방 종양 진행을 가속화하는 또 다른 메커니즘일 수 있습니다.
일반적으로 전이는 암 관련 사망률의 90% 이상을 차지하며 유방암 관련 사망의 주요 원인입니다. 국소 유방암 환자의 5년 생존율은 98%이며, 전이성 유방암 환자의 경우 26%로 급격히 감소합니다. F. nucleatum의 전이 기전을 완전히 이해하려면 더 많은 연구가 필요합니다.
10. 잠재적인 진단적 바이오 마커로서의 푸소박테리움
마이크로바이옴 기반 종양학 진단은 종양 검출을 위한 유망한 새로운 접근 방식입니다. 최근 보고서는 종양 스크리닝을 위한 혈장 유래 무세포 미생물 핵산의 잠재력을 입증했습니다. 종양이 있는 기증자의 샘플과 건강한 기증자의 샘플 및 32가지 다른 암 유형 간에 좋은 식별이 이루어졌습니다. 따라서, 종양에서 F. 뉴클레아툼의 과잉은 종양 검출을 위한 전략으로서 활용될 수 있다. 여러 가지 접근 방식이 탐색되었지만 적절한 스크리닝 기능은 아직 달성되지 않았습니다.
10.1. CRC 검출을 위한 대변 스크리닝
암의 조기 발견은 CRC 사망률을 줄이는 데 중요합니다. 분변 잠혈 검사(FOBT)는 CRC를 선별하는 일반적인 비침습적 비용 효율적인 방법입니다; 그러나 FOBT는 중간 정도의 감도를 가지고 있습니다.
거의 10년 전, F. 뉴클레아툼은 건강한 피험자에 비해 결장직장 선종 및 암종 환자의 대변 샘플에서 풍부한 것으로 보고되었습니다. 이후 많은 보고서, 특히 아시아 코호트와 관련된 보고서가 이 발견을 뒷받침했습니다. 최근의 검토 및 메타 분석은 대장암 검출을 위한 분변 F. 뉴클레아툼 기반 검사의 가능성을 입증했습니다. 그러나 이를 확인하기 위해서는 추가 임상 시험을 수행해야 합니다.
F. 뉴클레아툼과 FOBT의 분변 정량화의 조합은 후자의 특이성과 민감도를 증가시키는 것으로 나타났으며, 결장직장암에 대한 대규모 비침습적 샘플을 사용하는 대규모 인구 기반 스크리닝 전략으로서 이 조합 방법의 적용 가능성을 나타냅니다. 현재까지, F. 뉴클레아툼의 정량화는 정량적 PCR을 사용하여 수행되었다. 새로운 항체 또는 효소 기반 분석법의 향후 개발로 단일 검사에서 FOBT와 분변 푸소박테리아 검사(FFT)의 조합이 가능할 것으로 예상됩니다.
10.2. 항체 반응에 기초한 종양 검출
혈청, 타액 또는 분변 항-F. 뉴클레아툼 항체를 기반으로 한 면역 분석은 또한 CRC 스크리닝을 위한 새로운 기회를 제공할 수 있습니다. 지금까지 혈청 항-F. 뉴클레아툼 항체는 충분한 특이성과 민감도를 가진 CRC 환자와 대조군을 구별할 수 없었습니다. 한 연구에서는 다중 혈청학 분석을 사용하여 대장암 환자의 진단 전 혈청 샘플과 일치하는 대조군(각각 n = 11)에서 485 F. 뉴클레아툼 재조합 항원에 대한 항체 반응을 동시에 측정했습니다. 그러나 대장암 위험은 각 F. 뉴클레아툼 단백질에 대한 항체 반응 또는 11개 단백질 중 하나에 대한 결합 양성과 유의하게 연관되지 않았습니다. 후속 연구에서 ELISA 기반 검사에서 CRC 그룹의 F. nucleatum IgA 및 IgG 항체 수치가 건강한 대조군의 수치보다 높은 것으로 나타났습니다. 그러나 ELISA 검사의 판별력은 진단에 적합하지 않았다. 특히, F. 뉴클레아툼 및 특히 Fap2에 대한 혈장 항-F. 뉴클레아툼 IgG 수준 및 타액 IgA 수준은 최근 췌장 악성 종양과 관련이 있는 것으로 보고되었습니다. 그러나 이러한 결과의 진단 가능성은 향후 연구에 의해 확인되어야 합니다.
11. F. 뉴클레아툼을 이용한 항종양 치료 전략
11.1. 종양 집락화된 F. 뉴클레아툼의 제거
위에서 언급했듯이(섹션 9), 종양의 높은 푸소박테리움 부하는 인간의 불량한 질병 결과와 관련이 있습니다.동물 모델에서 전신 항생제 치료는 종양 집락화된 푸소박테리아를 제거하고 이후 푸소박테리아 유발 종양 악화를 억제하여 암 환자에 대한 항생제 치료의 유효성을 시사합니다. 불행히도 어떤 경우에는 항생제가 항종양 치료를 방해할 수 있습니다. 장내 미생물은 항 종양 화학 요법에 영향을 줄 수 있으며, 면역 요법, 방사선 치료 및 동종 골수 이식 다양한 제안 된 메커니즘을 통해.항생제 치료 후 장내 미생물군을 회복하기 위한 대변 이식은 특히 미래에 대변 이식이 항암(화학요법, 면역치료) 치료를 돕는 것으로 간주되는 경우 이 문제를 해결할 수 있습니다. 박테리오파지는 박테리아를 잡아먹고 복제하는 바이러스입니다. 종양 집락화된 F. nucleatum을 포함한 특정 종양균을 표적으로 삼기 위한 박테리오파지의 사용이 최근에 제안되었습니다. 중요한 것은 종양 집락화된 F. 뉴클레아툼을 박멸할 가능성이 있는 푸소박테리아 박테리오파지가 최근에 확인되었다는 것입니다.
11.2. F. nucleatum 및 Fap2를 사용한 종양 표적화 전략
글리칸 과다 표시 종양에 대한 특이적 귀환으로 인해 F. nucleatum 또는 Fap2는 잠재적으로 높은 수준의 Gal-GalNAc(또는 관련 당)를 나타내는 종양 및 전이를 표적으로 하는 플랫폼으로 사용될 수 있습니다. F. nucleatum의 유전자 조작의 최근 발전 예를 들어 FadA 돌연변이 및/또는 TIGIT 및 CEACAM1 활성화를 무효화함으로써 미래에 푸소박테리아 종양 강화 작용을 약화시키는 능력을 촉진했습니다. 그런 다음 이러한 약화된 균주는 항암 페이로드를 발현하도록 설계될 수 있습니다. 가능한 항종양제에는 훈련된 선천성 면역을 유도하는 항원, 또는 선천성 및 후천성 항종양 면역 반응을 유도하는 항원 및/또는 비독성 전구약물을 세포용해 약물로 국소적으로 전환시키는 효소가 포함될 수 있습니다. 이러한 전략은 현재 살모넬라균과 리스테리아균을 포함한 여러 종양 집락화 박테리아로 테스트되고 있습니다.
중요한 것은 살아있는 박테리아가 현재 암 치료에 사용된다는 것입니다. 부작용이 있는 경우 항생제를 사용하여 이 치료를 종료할 수 있습니다. 삼십 년이 넘는 기간 동안 결핵 백신인 생균 Calmette-Guérin의 방광 내 투여는 방광암 치료에 사용되었습니다. 일화적으로, BCG로 치료받은 방광암 환자는 BCG로 치료받지 않은 환자에 비해 알츠하이머 병과 파킨슨 병의 위험이 현저히 감소했습니다. 신경 퇴행성 질환에 대한 BCG의 유익한 효과는 장기적인 비특이적 면역 효과의 활성화 가능성에 기인합니다.
이 종양 표적화 접근법의 보다 발전된 버전은 위에서 설명한 것과 같은 항암 페이로드를 발현하도록 조작된 박테리오파지로 종양 집락화된 푸소박테리아를 표적으로 삼을 수 있습니다. 항종양 약물인 이리노테칸 덱스트란 나노입자의 파지 유도 캡슐화는 최근 종양 억제 클로스트리디움 부티리쿰의 성장을 촉진하기 위해 제안되었습니다. 조작된 나노캡슐은 종양 집락화된 푸소박테리아를 표적으로 하는 파지에 공유 결합되었습니다. 종양 성장을 제어하는 파지 유도 나노 입자의 능력은 결장암의 두 마우스 모델에서 입증되었습니다.
F. nucleatum과 유사하게, 말라리아의 원인 인 Plasmodium falciparum은 태반과 종양 모두에서 발견됩니다. Fap2의 유사체에서 말라리아에 감염된 적혈구가 태반과 종양에 축적되는 것으로 추측되는 말라리아 단백질은 VAR2CSA입니다. 임신과 관련된 말라리아 동안 말라리아 기생충은 감염된 적혈구의 표면에서 VAR2CSA 단백질을 발현합니다. VAR2CSA 콘드로이틴 설페이트에 결합하여 태반의 syncytiotrophoblast에 감염된 적혈구의 특이적 고정을 가능하게 합니다. Fap2 종양태아 리간드 Gal-GalNAc와 유사하게 콘드로이틴 설페이트는 태반 영양막과 암세포 사이에서 공유되는 종양태아 항원입니다.
마그네틱 비드에 결합된 재조합 VAR2CSA(rVAR2)은 혈액 샘플에서 순환하는 종양 세포를 포착할 수 있으므로 새로운 암 진단을 위한 잠재적인 도구 역할을 합니다. 독소를 rVAR2에 접합하면 항종양 치료제도 지시할 수 있습니다. VAR2CSA-콘드로이틴 설페이트와 Fap2-Gal-GalNAc 상호 작용에 의해 수행되는 병렬 역할은 흥미롭고 추가 조사가 필요합니다. 종양 검출 및 치료를 위한 Fap2의 보완적 활용도 탐구해야 합니다.
12. 끝 맺는 말
알파 버그라는 용어 박테리아 드라이버라고도 합니다. 직접적인 발암성 특징 또는 지역 박테리아 군집을 점막 면역 반응 및 상피 세포 변화를 촉진하는 것으로 전환하여 결과적으로 결장직장암의 발병을 초래하는 능력을 가진 마이크로바이옴의 특정 구성원을 설명하기 위해 제안되었습니다.
알파 버그는 또한 암을 보호하는 미생물 종을 선택적으로 "밀집"함으로써 발암을 향상시키는 것으로 제안되었습니다.
"고전적인" 박테리아 드라이버는 암 형성을 시작할 수 있는 독성 인자를 가지고 있습니다. 이러한 요인에는 단일 가닥 DNA 절단을 유도할 수 있는 여러 대장균 균주의 콜리박틴 유전독소가 포함됩니다 및 B. fragilis 독소 fragilysin (BFT). 메탈로프로테이나제인 BFT는 결장 상피 세포에 유전독성이 있으며, 활성 산소 종의 생성 증가와 DNA 손상에 기여하는 폴리아민 이화 효소인 스페르민 산화효소를 상향 조절합니다. Fragilysin은 또한 종양 억제 단백질 E-cadherin의 절단과 관련된 메커니즘에서 장 상피 세포의 증식을 촉진합니다.
현재 H. pylori는 직접 발암 물질로 분류되는 유일한 박테리아입니다. 역학적 증거 및 실험 데이터에 따르면 H. pylori의 유병률은 위 선암 및 위 점막 관련 림프 조직(MALT) 림프종의 발병과 관련이 있습니다. 위 점막의 H. pylori는 만성 염증 과정에서 결정적이며, 이는 위암 발병으로 이어집니다. 따라서 박테리아 IV형 분비를 통해 위 상피 세포로 전달되는 H. pylori의 세포독소 관련 유전자 A(CagA) 단백질은 포유류에서 악성 신생물을 유도할 수 있는 종양 단백질입니다.
위에서 언급한 암 동인과 달리 현재의 증거에 따르면 F. nucleatum은 "승객"입니다. 이미 형성된 종양을 식민지화하고 β-카테닌 신호 전달의 조작을 통해 진행을 가속화하는 박테리아, 숙주 사이토카인 생산(IL-8 및 CXCL1),항종양 면역 및 내화학성이며, 이러한 메커니즘은 그림에 설명되어 있습니다.
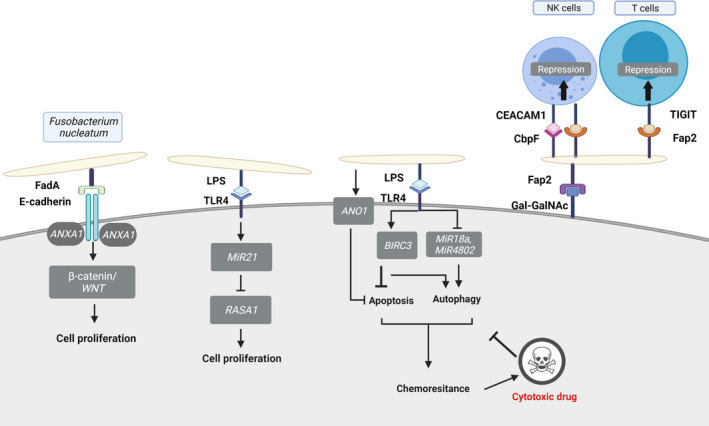
종양 진행을 가속화하기 위해 F. 뉴클레아툼에 의해 이용되는 다양한 메커니즘. 푸소박테리아 Fap2 도메인은 종양 표시 Gal-GalNAc에 결합하여 종양 집락화를 가능하게 합니다. 종양 가속은 다음과 같은 메커니즘으로 매개됩니다
F. 뉴클레아툼의 발생은 증가하는 종양 유형에서 불량한 질병 결과와 관련이 있는 것으로 밝혀졌으며, 이는 종양 내 푸소박테리아를 표적으로 하는 것이 예후를 개선할 것임을 시사합니다.
높은 Gal-GalNAc 수준은 fusobacteria에 의해 집락화된 모든 종양 유형에서 발견되며, 이는 Fap2에 대한 리간드 역할을 하여 fusobacteria에 의한 종양 집락화의 특이성에 역할을 하는 종양 항원임을 나타냅니다. 따라서 fusobacterial 과잉 과잉이 모든 Gal-GalNAc 과다 표시 종양에서 발견 될 것이라고 가정하는 것은 유혹적입니다. 종양 특이성으로 인해 fusobacteria와 Fap2는 종양 스크리닝 및 치료에 사용할 가능성이 있습니다.
푸소박테리아 부착물 FadA는 E-cadherin에 결합하여 β-카테닌/WNT 신호 전달 경로를 활성화하여 세포 증식을 촉진합니다.
박테리아 내독소 지질다당류(LPS)는 Toll-like receptor 4(TLR4)를 활성화하여 miR21의 상향 조절을 유발합니다. 이것은 RAS GTPase RASA1의 수준을 감소시키고 RAS-미토겐 활성화 단백질 키나아제(MAPK) 캐스케이드를 활성화하여 세포 증식을 향상시킵니다.
푸소박테리움 뉴클레아툼 TLR4와의 LPS 상호작용은 또한 카스파제 캐스케이드를 직접 억제함으로써 세포자멸사를 억제하는 BIRC3를 상향조절할 수 있으며, 이에 따라 세포독성 약물에 대한 세포 내성을 증가시킨다. 또한, LPS/TLR4 상호작용은 자가포식 요소 ULK18 및 ATG4802의 발현과 관련된 miR1a 및 miR7의 발현을 하향 조절하여 자가포식을 증가시키고 결과적으로 치료에 대한 세포 내성을 향상시킵니다.
마지막으로, F. 뉴클레아툼은 TLR1 의존적 방식으로 발현 아녹타민-1(ANO4)을 상향 조절하여 내화학성에 기여함으로써 세포자멸사를 억제합니다.
Fap2의 비-렉틴 도메인은 인간 TIGIT 체크포인트를 활성화시킴으로써 종양 부위에서 TILs 및 NK 세포의 항-종양 활성을 억제한다.
Fusobacterial CbpF는 인간 CEACAM1 체크포인트를 활성화하여 TIL과 NK 세포의 항종양 활성을 추가로 억제합니다.
승인
이 연구는 이스라엘 암 연구 기금 프로젝트 보조금 (GB), 이스라엘 과학 재단 Moked 보조금 및 이스라엘 과학 기술부 맞춤 의학 보조금 (GB 및 OM)의 지원을 받았습니다. TAM은 AdR Women Doctoral Program의 펠로우입니다. 그림은 BioRender.com 사용하여 만들어졌습니다.

